肌动蛋白丝是构成细胞内部骨架的蛋白质纤维。作为我们细胞的活性元素,肌动蛋白丝支持细胞的融合、运动并参与许多其他细胞过程。重要的是,它们也是肌肉细胞的主要成分。自1940年代发现以来,这些细丝的结构复杂性一直令科学家着迷,并在它们促进细胞许多过程的能力背后打开了一片未解之谜。
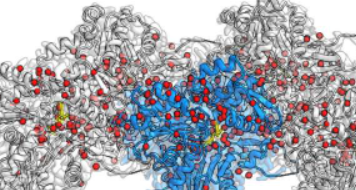
德国多特蒙德马克斯普朗克分子生理学研究所的研究人员首次成功地可视化了肌动蛋白丝中的数百个水分子,代表了肌动蛋白研究的一次质的飞跃。
使用电子冷冻显微镜(cryo-EM)技术,StefanRaunser小组以前所未有的细节揭示了肌动蛋白如何以丝状排列在一起,ATP(细胞的能量来源)如何位于蛋白质袋中,以及单个水的位置分子定位自己并与ATP反应。
“我们正在回答科学家们几十年来一直试图回答的基本生命问题,”Raunser说。在真核细胞中,肌动蛋白含量丰富,并且倾向于连接在一起(聚合)成细丝。
中央肌动蛋白亚基为蓝色,其他四个亚基为灰色。对应于水分子的密度为红色,ADP为黄色。学分:分子生理学MPI
这些细丝构成了构成细胞细胞骨架的网络,并通过运动控制各种细胞过程。例如,免疫细胞使用肌动蛋白丝来移动和捕杀细菌和病毒。
研究人员已经知道,细丝的动力学受到ATP水解的调节——ATP与水的反应会裂解磷酸基团并产生能量。然而,之前仍未得到解答的是这个过程背后的确切分子细节。
太灵活,太大了?——不适合冷冻电镜
由于肌动蛋白丝对于X射线结晶和核磁共振来说太柔韧或太大,因此冷冻电镜一直是获得详细图像的唯一可行技术。2015年,Raunser的团队使用冷冻电镜描绘了一种新颖的细丝三维原子模型,分辨率为0.37纳米。2018年,他的小组描述了肌动蛋白在丝状体中获得的三种不同状态:与ATP结合,在裂解的磷酸盐存在下与ADP结合,在磷酸盐释放后与ADP结合。
水分子如何运动
在他们目前发表在《自然》杂志上的研究中,Raunser和他的同事们能够创造新的分辨率记录:他们获得了分辨率约为0.2纳米的所有三种肌动蛋白状态,从而使以前不可见的细节变得可见。三维图不仅显示了蛋白质的所有氨基酸侧链,还揭示了数百个水分子的位置。
通过比较这些新结构和孤立肌动蛋白的结构,他们能够推断出水分子是如何运动的。聚合后,水分子以这样的方式重新定位在ATP口袋中,只有一个水分子留在ATP前面,准备攻击一个磷酸盐并引发水解。
通过这种方法获得的准确性可以帮助该领域的进一步研究:“我们的高分辨率模型可以推动科学家设计用于组织光学显微镜研究的小分子,并最终用于治疗应用,”Raunser说。
开门机?
作者还阐明了磷酸盐的最终命运。此前,科学家们认为ATP口袋中有一个后门,在ATP水解后仍保持打开状态,以促进磷酸盐的排出。然而,新的低温电磁结构没有显示出任何开放后门的痕迹。因此,释放机制仍然是一个谜。
“我们相信有一扇门,但它可能会暂时打开,”Raunser评论道,他现在想使用数学模拟和时间分辨低温EM方法来证明磷酸盐是如何排出的。显然,这些激动人心的发现为科学家们打开了大门,让他们可以更深入地挖掘,以期发现肌动蛋白丝促进细胞运动的过程背后的更多细节。

