中科大张凯明教授团队利用低温电子显微镜(cryo-EM)解析了四膜虫核酶第二步自剪接过程中的6个构象,揭示了第1组内含子协调的机制自剪接反应。他们的工作发表在Nature Communications上。
Ⅰ族内含子是催化性RNA,可以在金属离子的帮助下折叠成具有活性位点的结构,从而在没有蛋白质的情况下促进催化作用。然而,由于RNA的异质性和灵活性,RNA结构的分析面临着巨大的挑战。自发现四膜虫 I 组内含子以来,大量研究阐明了其潜在的催化机制,但尚未获得全长分子的 3D 结构及其重排。
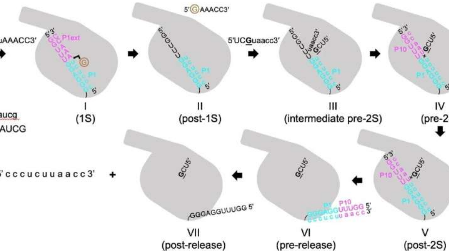
为了解决自剪接反应的结构机制和构象变化,张凯明教授团队首先设计了自剪接反应的底物。在验证底物可以完成催化反应并确定最佳反应条件后,该团队使用单粒子冷冻电镜分析在自加香过程中捕获了四膜虫核酶不同构象的结构快照。
第一步从寡核苷酸底物碱基与脱辅基酶配对开始,形成 P1-P1 延伸双链体。之后,P1 与催化核心内的三个单链片段之间的相互作用介导双链体与活性位点的对接。
然后释放第一步的寡核苷酸产物。第二步是连接反应,其中 3'-外显子底物通过接触和金属配位停靠在核酶中。然后反应逐渐进入中间阶段,金属配位减弱,相互作用消失。
外显子在此期间连接。随后,核酶松弛,产物双链体脱离,到达无底物位点。最后,双工取消配对并发布产品。此外,研究人员还发现了一些氢键和金属离子在活性位点上重排的结构证据,这些重排促进了催化作用并协调了自剪接反应。
该研究在原子水平上揭示了自剪接反应的机制,证明了使用冷冻电镜解析 RNA 结构的优势。随着冷冻电镜在结构异质分子研究中的应用越来越多,它将成为许多其他生物学研究(如 RNA 系统的折叠)的重要工具。

