金泽大学的研究人员在美国国家科学院院刊上报告了高速原子力显微镜实验,这些实验显示了与刺激和抑制TRPV1蛋白激活相关的配体如何增加和减少分子的结构变异。这些观察提供了对这些热敏和辣椒敏感蛋白如何发挥作用的见解。
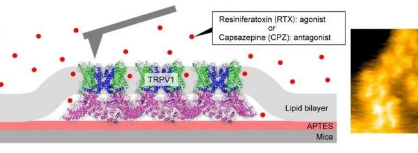
皮肤通过激活称为瞬时受体电位香草素成员1(TRPV1)的蛋白质受体来感知热量——既来自温度升高,也来自辣椒中的辣椒素等分子。然而,TRPV1功能背后的机制尚不清楚。现在,日本金泽大学的AyumiSumino和中国复旦大学的MotoyukiHattori及其同事对这一机制提供了重要见解。
使用高速原子力显微镜比较蛋白质在刺激或抑制与其结合的分子(配体)的情况下,他们获得了他们所描述的“第一个实验证据,表明分子波动与门控状态(配体结合)之间的相关性””
一旦被激活,TRPV1通道就会打开,允许离子渗透并向神经系统发出存在有害兴奋剂的信号。2011年,美国霍华德休斯医学研究所的研究人员从热力学角度提出了激活受体的理论基础,这一理论框架此后被实验所证实。
这个想法是分子会通过热容量的变化来响应热量,这与分子构象的波动有关。TRPV1蛋白的结构从之前的低温电子显微镜研究中已知,但这些并没有阐明蛋白质构象的波动如何随着刺激或抑制分子而变化,甚至温度和辣椒感应是否具有相同的分子机制。
原子力显微镜(AFM)通过距离对位于表面正上方的纳米尖端上的力的影响来感测表面的拓扑结构。显微镜于1986年首次发明,但通过金泽大学的工作得以复兴,使其能够高速捕捉拓扑结构,从而为了解结构动力学提供了一个窗口。
Sumino、Hattori及其同事使用高速AFM对处于未结合状态和与刺激(激动剂)或抑制(拮抗剂)蛋白质活性的配体分子结合时的TRPV1受体进行成像。他们使用比辣椒素热1,000倍的树脂毒素分子作为激动剂,他们使用辣椒素作为拮抗剂,它可以阻断辣椒素的疼痛。
从捕获的结构中,研究人员能够观察到TRPV1的结合和未结合状态的构象波动。他们发现树脂毒素会增加构象波动,而辣椒素会抑制它们。
尽管构象波动非常小(大约为埃),但研究人员强调了文献中的证据,表明这种规模的构象变化足以影响通道的离子渗透性。在他们的工作报告中,研究人员得出结论,“总的来说,这项研究表明结构波动的重要性,这将是TRPV1热敏的关键因素。”

