Omicron变异刺突蛋白与人类ACE2复合物的首次分子水平结构分析现已推出。使用冷冻电子显微镜进行近原子分辨率分析,可以深入了解严重突变的Omicron变体如何附着和感染人类细胞。
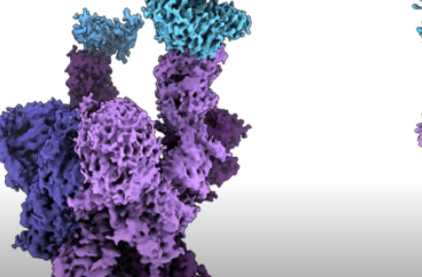
这项工作发表在《科学》杂志上的论文“SARS-CoV-2Omicron变体:刺突蛋白-ACE2复合物的抗体逃避和冷冻电镜结构”中。”
不列颠哥伦比亚大学生物化学和分子生物学教授SriramSubramaniam博士说:“了解病毒刺突蛋白的分子结构非常重要,因为它将使我们能够在未来开发出针对Omicron和相关变体的更有效的治疗方法。”。“通过分析病毒感染人类细胞的机制,我们可以开发出更好的治疗方法来破坏该过程并中和病毒。”
刺突蛋白位于SARS-CoV-2的外部,使其能够进入人体细胞。Omicron变体的刺突蛋白上有前所未有的37个突变,是之前变体的三到五倍。
结构分析显示,几个突变(R493、S496和R498)在刺突蛋白和人类细胞受体ACE2之间创建了新的盐桥和氢键。研究人员指出,这些相互作用“似乎补偿了其他Omicron突变,例如已知会降低ACE2结合亲和力的K417N,从而导致Delta和Omicron变体具有类似的生化ACE2结合亲和力。”
Subramaniam说:“总体而言,研究结果表明Omicron比原始病毒具有更高的结合亲和力,其水平与我们在Delta变体中看到的水平更相似。”“值得注意的是,尽管发生了如此广泛的突变,Omicron变体仍然进化到保留了与人类细胞结合的能力。”
研究人员进行了中和测定,结果表明展示Omicron刺突蛋白的假病毒表现出增强的抗体逃避能力。与之前的变体相比,Omicron对所测试的所有六种单克隆抗体均表现出可测量的逃避,其中五种完全逃避。该变体还显示出对从接种疫苗的个体和未接种疫苗的COVID-19患者收集的抗体的逃避增加。
“值得注意的是,与未接种疫苗的患者自然感染的免疫力相比,Omicron较少回避疫苗产生的免疫力。这表明疫苗接种仍然是我们最好的防御措施,”苏布拉马尼亚姆说。
作者指出,抗体逃避的增加,“加上ACE2界面上强相互作用的保留,代表了可能有助于Omicron变体快速传播的重要分子特征。”
根据观察到的结合亲和力和抗体逃避的增加,研究人员表示,刺突蛋白突变可能是Omicron变体传播性增加的因素。

