密歇根大学的一组研究人员开发出一种新的抗癌药物,它通过肠道淋巴系统而不是血管吸收,有可能克服导致耐药性的分子信号通路,同时提高抗癌能力并减少副作用.在他们报告的研究中,科学家们表明,这种激酶抑制剂可显着减少患有骨髓纤维化(急性白血病的前兆)小鼠的疾病、有限的毒性和延长的存活期。
密歇根大学医学院RogerA.Berg放射学研究教授BrianD.Ross博士是该团队在NatureCommunications上发表的论文的主要作者,该论文的标题为“一种淋巴吸收的多靶点激酶抑制剂用于骨髓纤维化治疗。”
癌症治疗通常涉及针对不同癌细胞脆弱性的联合疗法。但由于这些药物以不同的速率在体内循环并被身体吸收和清除,因此在限制药物毒性和副作用的同时维持每种药物的正确治疗平衡可能具有挑战性。
未能达到这种平衡会降低药物组合对癌症的有效性,并可能导致耐药性,因为磷酸肌醇3-激酶(PI3K)和丝裂原活化蛋白激酶(MAPK)串扰会激活下游通路以抵抗治疗。(PI3K和MAPK是驱动高比例癌症的关键分子信号通路。)即使一种药物阻断了一条通路,另一种药物也可以提供逃避生存通路来补偿并继续生长。
作者解释说,“PI3K和MAPK是实体恶性肿瘤中变化最大的致癌信号通路之一,由于靶点抑制不足、代偿性信号通路的激活和下游靶点趋同……使用激酶进行治疗,因此使用单通路抑制剂的临床效率很低抑制剂组合在临床上仍然是一个挑战,因为试验一直在努力在生存、治疗效果和剂量限制毒性之间取得积极的平衡。”
由Ross及其同事设计的口服化合物LP-182可以同时靶向PI3K和MAPK信号通路。“使用合成药物化学和计算对接研究,我们报告了针对PI3K和MAPK信号通路的有效和选择性、口服生物可利用的单分子多功能激酶抑制剂(LP-182)的开发,”研究人员指出。
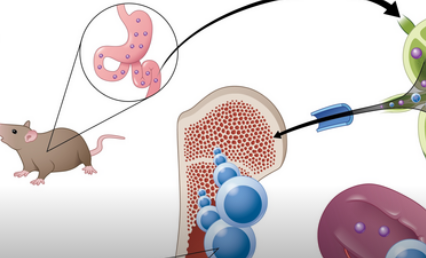
在骨髓纤维化中,骨髓中会形成过多的疤痕组织,从而破坏正常的血细胞生成。过度活跃的分子信号导致恶性干细胞增殖、广泛纤维化、脾脏肿大和进行性骨髓衰竭。这种疾病通过淋巴组织传播,这也是癌症转移的常见途径,因此罗斯和他的团队的研究结果可能会提供预防癌症扩散的新策略。
与通常被设计为被快速吸收到血液中的传统口服药物不同,使用LP-182治疗骨髓纤维化小鼠模型的研究人员证实,这种新化合物首先被肠道淋巴系统吸收。淋巴系统充当储存库,将化合物与身体的其他部分分离,并随着时间的推移逐渐将其释放到全身循环中,以将药物浓度维持在最佳治疗水平。“LP-182在体外和体内实现了对PI3K和MAPK信号通路的选择性和有效抑制,”作者指出。”......我们通过减少下游激酶激活、改善疾病表型和提高骨髓纤维化动物模型的存活率来证明选择性和治疗效果兄弟。”
此外,Ross说,由于肠道的淋巴系统含有人体一半以上的免疫细胞——“超过90%的淋巴细胞库位于淋巴系统内,其中大约50%位于肠道淋巴和淋巴组织中,”团队表示——结果可能指向治疗自身免疫性疾病和其他疾病的新方法。“使用淋巴定向小分子调节靶标的能力创造了形成恶劣环境的前景,以破坏异常信号转导、细胞运输和免疫细胞网络,从而降低‘保护性’淋巴生态位内的生存能力,”研究人员建议。“因此,
Ross进一步评论了这项新报告的研究,他说:“在治疗窗口内,我们能够维持对两种相互对话的不同通路的靶向抑制。这证明了将抗癌药物直接输送到淋巴系统的可行性,这为改善癌症治疗结果和减少药物本身的副作用开辟了巨大的新机会。”Ross还是密歇根医学院分子影像中心主任和UMRogel癌症中心临床前分子影像共享资源主任。
作者承认需要对淋巴吸收化合物的运输和特性进行更多研究。尽管如此,他们指出,“所提出的合成药物化学策略提供了一个灵活的基础以及刺激进一步设计靶向单个或多个信号通路的淋巴性化合物的动机......LP-182的原型设计为开发淋巴性化合物建立了基准,包括药物再利用,现有药物可用于淋巴输送,以提供创新的治疗机会。”
研究人员旨在继续扩大他们对LP-182的临床前研究,目标是在人类骨髓纤维化患者中开展I期临床试验。他们还在开发其他嗜淋巴靶向激酶抑制剂来治疗实体瘤,包括乳腺癌、脑癌、胃肠道癌和胰腺癌,以及狼疮和多发性硬化症等自身免疫性疾病。该团队得出结论:“我们对小分子淋巴吸收的合成和物理化学特性的进一步表征将支持淋巴疗法的持续进步,以改变无数人类疾病适应症的疾病轨迹。”

